高通量测序的进展推动了蛋白质序列数量的快速增长。尽管如此,由于实验研究需要较长的周期并且费用昂贵,大部分蛋白质序列缺乏功能注释。因此,具备自动而准确推断蛋白质功能的计算方法变得至关重要。
深度学习的进展推动了各种蛋白质功能预测模型的发展。蛋白质的三维结构与功能密切相关,然而,结构相似的蛋白质可能具有高度多样的序列。仅仰赖基于序列的模型(如1D CNN或Transformer)可能难以捕捉到长程的功能位点规律。随着蛋白质结构预测研究的突破性进展,获取蛋白质接触图或三维结构的方法变得更加容易。这为图神经网络(GNN)提供了更多优势,它可以编码蛋白质的三维结构信息以预测其功能。然而,目前的GNN模型仍然面临过度平滑的问题,而且简单的池化方法难以准确突显重要的残基节点贡献。
伟德国际1946官网、定量生物学中心、伟德国际1946官网-清华大学生命科学联合中心来鲁华课题组与伟德国际1946官网数学科学学院、定量生物学中心邓明华课题组合作发展了一种新的蛋白质功能预测模型:HEAL(Hierarchical graphtransformEr with contrAstive Learning)。HEAL利用Hierarchical Graph Transformer(HGT)来学习蛋白质的结构信息。该方法通过引入模仿功能motif的超节点,与蛋白质图中的残基节点进行交互,并通过池化操作生成蛋白质图的嵌入表示。为了增强网络的表达能力,HEAL还引入了图对比学习,以最大化不同视图之间的相似性。此外,HEAL模型还利用AlphaFold2预测蛋白质结构的功能信息,以提升在实际应用场景中的性能表现。
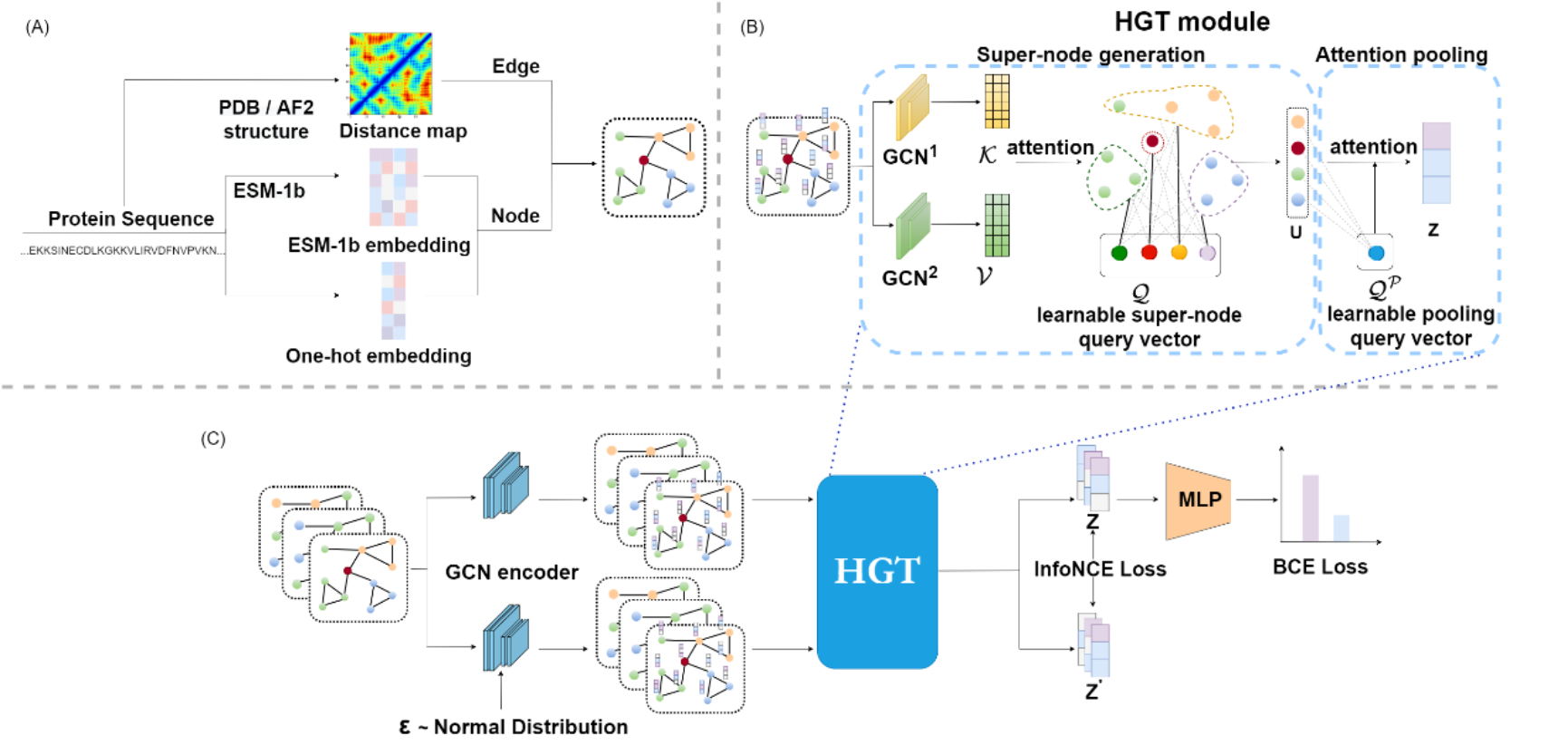
图1. HEAL模型对蛋白质的建图方式及网络架构
HEAL模型在被广泛使用的PDBch测试集上展现出了卓越的性能,不仅超越了传统的基于序列比对的方法(Blast和FunFams),还超越了基于序列特征的1D CNN深度学习模型DeepGO和基于结构特征的GNN模型DeepFRI。为了测试模型在缺乏实验解析结构与已标注同源序列的更真实场景下的应用,研究者构建了更具挑战性的AFch测试集,并将HEAL模型与前述的DeepFRI、以及结合同源序列比对和1D CNN序列模型的DeepGOPlus进行了比较。研究结果表明,在这个更具挑战性的应用场景下,HEAL模型显示出了更大的潜力和优势。
相关工作近日发表在Bioinformatics上,伟德国际1946官网北大-清华生命科学联合中心博士研究生顾仲晖与伟德国际1946官网数学科学学院罗霄博士为共同第一作者。伟德国际1946官网定量生物学中心的博士研究生陈佳晓对于该工作的完成做出了重要贡献。文章的通讯作者为伟德国际1946官网、定量生物学中心、伟德国际1946官网-清华大学生命科学联合中心来鲁华教授和伟德国际1946官网数学科学学院、定量生物学中心邓明华教授。该研究得到了国家重点研发计划、国家自然科学基金、中国医学科学院创新单元、北京分子科学国家研究中心和北大-清华生命科学联合中心的资助。
原文链接:https://doi.org/10.1093/bioinformatics/btad410