别构调控在酶催化、信号传导等多种生物学过程中发挥着重要作用。与传统的作用于生物功能位点的正构药物相比,别构药物由于具有更高的特异性、更少的副作用以及能有效克服已有的耐药性突变等独特优势而受到了广泛关注。但是别构分子与靶标蛋白之间更高的结合亲和力常常并不对应着更好的活性,因此别构分子的优化面临着很大的挑战。在别构位点中,各残基对别构效应的贡献有所不同,其中的关键残基决定了别构信号的传导方向和强度,而其它残基则主要起到辅助结合作用。找出别构位点中主要负责别构信号传导的残基(关键别构残基)对于理解别构调控机制、开展功能蛋白质与药物设计具有重要意义。目前还没有能够预测关键别构残基的有效方法。
伟德国际1946官网/前沿交叉学科研究院定量生物学中心来鲁华课题组、伟德国际1946官网前沿交叉学科研究院定量生物学中心/数学科学学院邓明华课题组和安徽农业大学理学院祝小雷课题组合作应用进化耦合模型对残基之间的共进化进行分析,发现蛋白质的正构位点和别构位点之间存在进化耦合,蛋白质序列上的弱共进化耦合项包含蛋白质功能信息。在此基础上发展了首个预测关键别构残基的计算方法KeyAlloSite,为别构药物的设计和优化、功能蛋白质设计等研究提供了有用的工具。相关研究近日发表在eLife上(eLife 12 (2023), https://elifesciences.org/articles/81850)。
在进化过程中,蛋白质中残基之间的功能耦合会驱动它们的共进化,而共进化的模式可以从多序列比对中获得。由于别构位点能够影响正构位点的功能,对于别构蛋白质数据集中的每个蛋白,作者首先利用进化耦合模型分析了正构口袋和别构口袋以及其它口袋之间的共进化耦合强度,并将共进化耦合强度归一化成Z-score。然后根据Z-score对别构口袋和其它口袋进行排序。研究发现92%的已知别构位点对应的Z-score都大于0.5,已知别构位点位于前3名的概率是96%,表明正构和别构口袋之间的共进化耦合强度强于正构和其它非功能口袋之间的进化耦合强度。
进一步通过两两比较别构口袋中的残基对应的进化耦合值之间的差异,推出别构口袋中的每个残基对应的显著性差异数,将残基对应的显著性差异数归一化为Z-score进行关键别构残基预测(图1)。KeyAlloSite预测的关键别构残基与多个蛋白质体系中的实验结果相一致。例如,在酪氨酸蛋白激酶ABL1(BCR-ABL1)中,KeyAlloSite预测的关键别构残基L359在别构信号传导中起着关键作用。当别构分子hit 4和L359之间没有相互作用时,hit 4尽管结合较强但是没有活性。别构分子hit 5由于和L359之间存在有利的疏水相互作用,所以尽管和hit 4相比结合亲和力更弱,但却具有酶抑制活性(图2)。
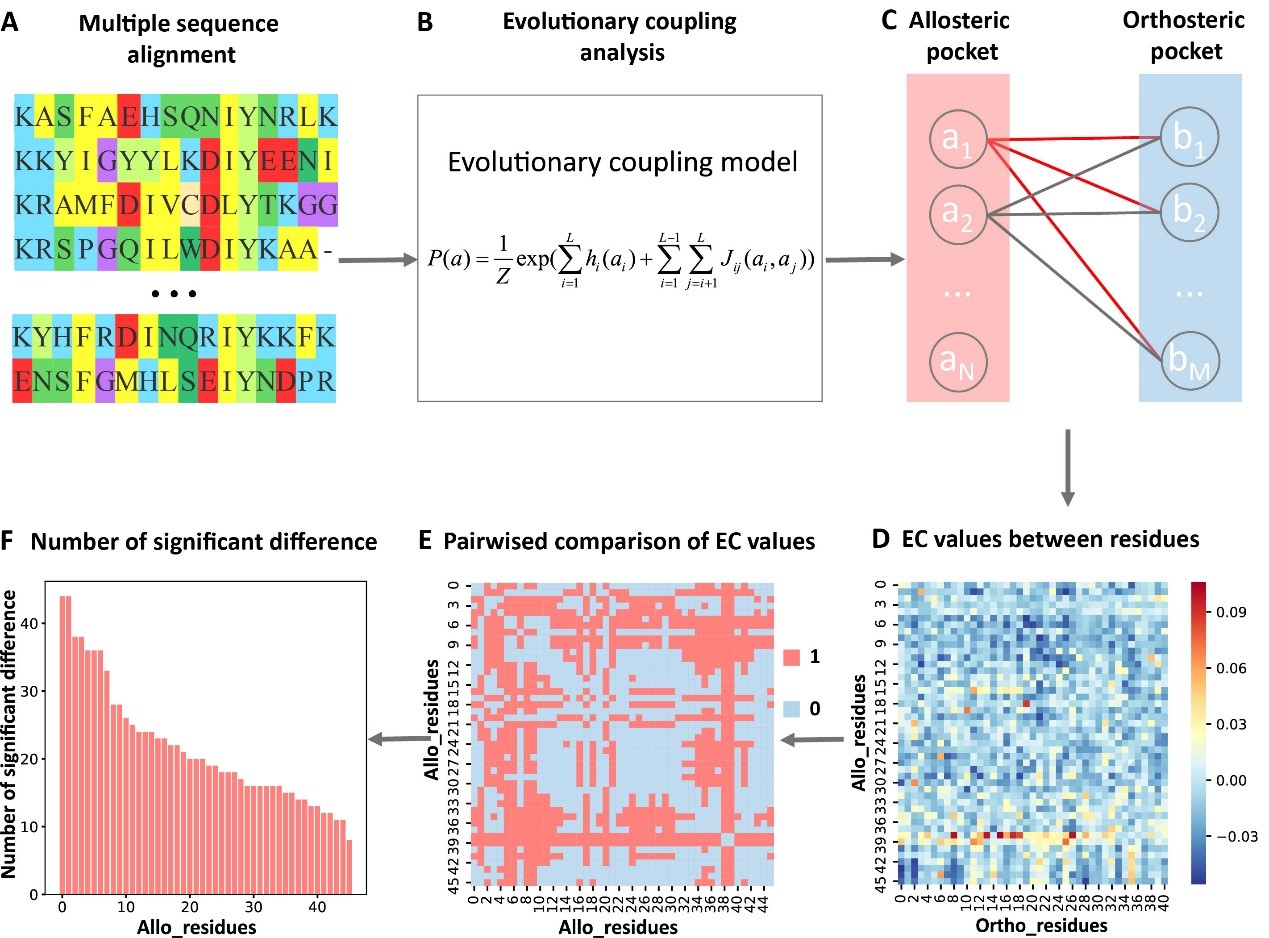
图1. 确定关键别构残基的步骤。
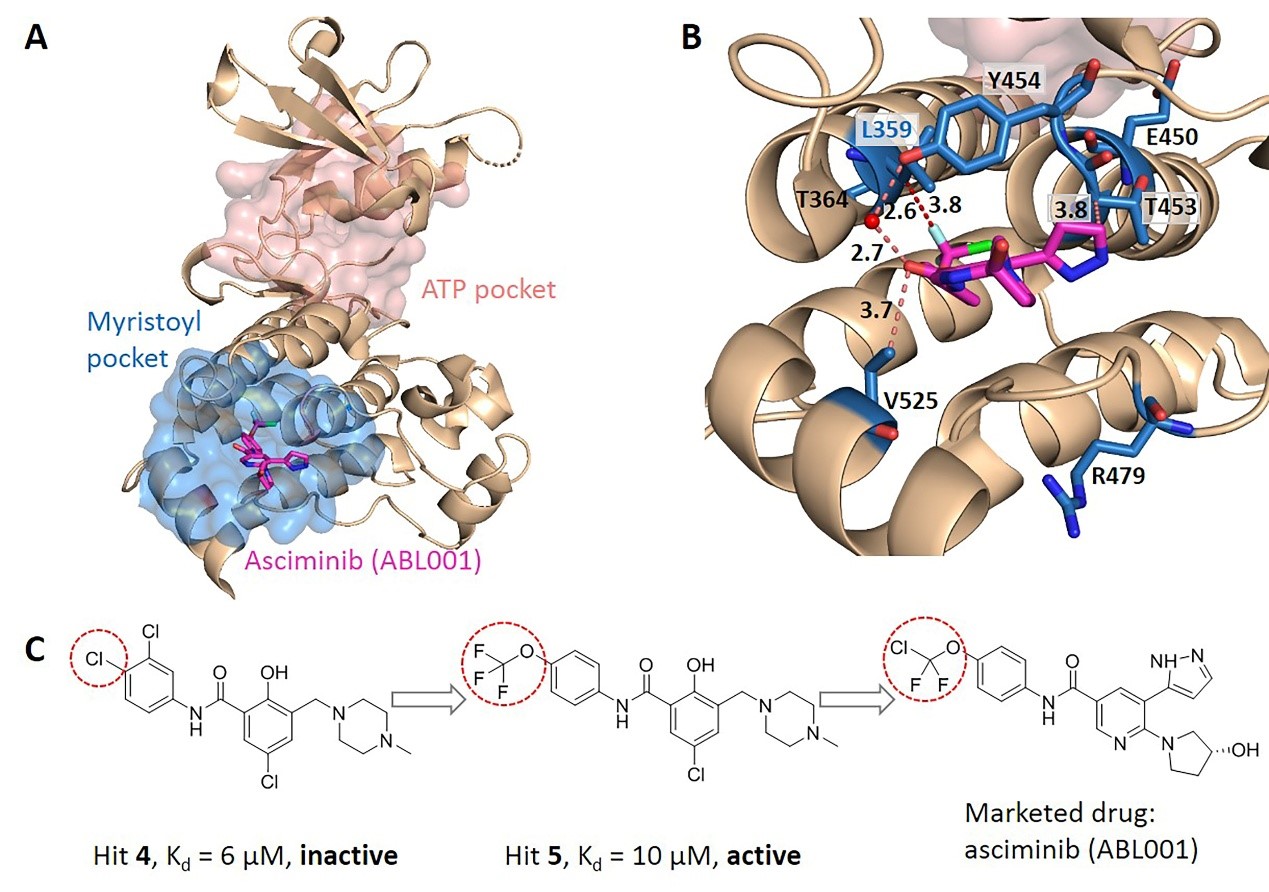
图2. KeyAlloSite在BCR-ABL1中预测的关键别构残基。
KeyAlloSite还可以预测酶中远离酶的底物结合位点但是对酶的催化活性有很大影响的关键别构残基。例如,在南极假丝酵母脂肪酶B(Candida antarctica lipase B)中,KeyAlloSite预测的关键别构残基A225和V37对酶的活性非常重要,将A225突变成M能够将酶的催化效率提升11倍,将V37突变成I能够将酶的催化效率提升3倍。
伟德国际1946官网前沿交叉学科研究院定量生物学中心博士后谢娟为该论文的第一作者,伟德国际1946官网/前沿交叉学科研究院定量生物学中心来鲁华教授为该论文的通讯作者,伟德国际1946官网前沿交叉学科研究院定量生物学中心/数学科学学院邓明华教授和安徽农业大学理学院祝小雷副教授为该研究提供了关键指导和帮助,伟德国际1946官网张伟林博士后(已出站)参与了该研究工作。该研究得到了国家自然科学基金重点项目、中国医学科学院创新项目、北京分子科学国家研究中心和伟德国际1946官网-清华大学生命科学联合中心的资助。
来鲁华课题组在蛋白质别构调控领域开展了系统研究,发展了系统性的别构药物设计方法并在多个体系中获得了别构活性化合物。他们的近期工作进一步揭示了蛋白质活性位点与别构位点在不同运动模式上的相关性,提高了基于蛋白质表面口袋及运动相关性分析的别构位点预测方法精度(J Chem Inf Mod 2022, 62, 187)。相关方法CorrSite2.0已整合进课题组发展的综合性蛋白质口袋分析在线计算服务器CavityPlus中(http://www.pkumdl.cn/cavityplus,Nucleic Acids Res, 2018, 46, W374),为蛋白质口袋分析、别构药物设计、功能预测等提供了计算工具。与化学学院刘志荣课题组合作揭示了别构调控与配体结合口袋受力分布的关系,第一次实现了蛋白质功能别构调控方向的预测,所发展的AlloType为蛋白质别构调控方向预测提供计算工具(J Phys Chem Lett 2021, 12, 5404);定量分析了动力学别构调控的贡献,揭示了熵驱动的动力学别构的本质(J Chem Inf Mod 2022, 62, 2538)。